Любое тело может находиться в разных агрегатных состояниях при определенных температуре и давлении - в твердом, жидком, газообразном и плазменном состояниях.
Для перехода из одного агрегатного состояния в другое происходит при условии, что нагревание тела из вне происходит быстрее, чем его охлаждение. И наоборот, если охлаждение тела из вне происходит быстрее, чем нагрев тела за счет его внутренней энергии.

При переходе в другое агрегатное состояние вещество остается прежним, останутся те же молекулы, изменится только их взаимное расположение, скорость движения и силы взаимодействия друг с другом.
Т.е. изменение внутренней энергии частиц тела переводит его из одной фазы состояния в другую. При этом это состояние может поддерживаться в большом температурном интервале внешней среды.
При изменении агрегатного состояния нужно определенное количество энергии. И в процессе перехода энергия тратится не на изменение температуры тела, а на изменение внутренней энергии тела.
Отобразим на графике зависимость температуры тела T (при постоянном давлении) от количества подаваемого к телу тепла Q при переходе из одного агрегатного состояния в другое.
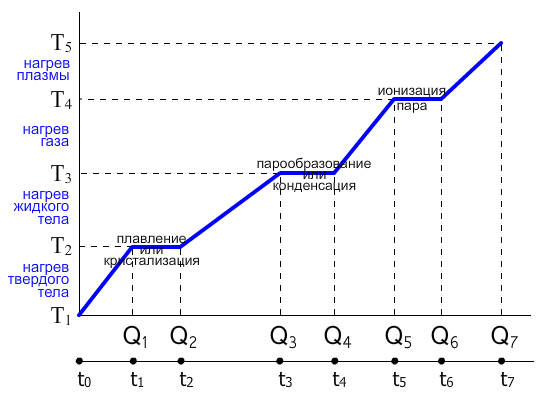
Рассмотри тело массой m, которое находится в твердом состоянии с температурой T1.
Тело переходит не моментально из одного состояния в другое. Сначала нужна энергия на изменение внутренней энергии, а на это нужно время. Скорость перехода зависит от массы тела и его теплоёмкости.
Начнем нагревать тело. Через формулы можно записать так:
Q = c⋅m⋅(T2-T1)
Столько тепла тело должно усвоить, чтобы нагреться с температуры T1 до T2.
Переход твердого тела в жидкое
Далее при критической температуре T2, которая для каждого тела своя, начинают рушиться межмолекулярные связи и тело переходит в другое агрегатное состояние - жидкость, т.е. межмолекулярные связи слабеют, молекулы начинаю перемещаться с большей амплитудой с большей скоростью и большей кинетической энергией. Поэтому температура одного и того же тела в жидком состоянии выше, чем в твердом.
Для того чтобы всё тело перешло из твердого состояния в жидкое, нужно время на накопление внутренней энергии. В это время вся энергия идет не на нагрев тела, а на разрушение старых межмолекулярных связей и создание новых. Количество энергии нужно:
Q = m⋅λ
λ - удельная теплота плавления и кристаллизации вещества в Дж/кг, для каждого вещества своя.
После того как всё тело перешло в жидкое состояние, эта жидкость опять начинает нагреваться по формуле: Q = c⋅m⋅(T-T2); [Дж].
Переход тела из жидкого состояния в газообразное
При достижении новой критической температуры Т3, начинается новый процесс перехода из жидкого состояния в парообразный. Чтобы дальше перейти из жидкости в пар, нужно затратить энергии:
Q = m⋅r
r - удельная теплота газообразования и конденсации вещества в Дж/кг, для каждого вещества своя.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой, а обратный ему процесс - десублимацией.
Переход тела из газообразного состояния в плазменное
Плазма - частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы.
Плазма обычно возникает при высокой температуре, от нескольких тысяч °С и выше. По способу образования различают два вида плазмы: термическую, возникающую при нагревании газа до высоких температур, и газообразную, образующуюся при электрических разрядах в газовой среде.
Этот процесс очень сложный и имеет простого описания, да и нам в бытовых условиях он не достижим. Поэтому не будем подробно останавливаться на этом вопросе.

